


Podstawą do jakichkolwiek rozważań w dziedzinach ścisłych jest znajomość budowy otaczającej nas materii. Otaczająca nas materia zbudowana jest z atomów. Przez większą część XIX wieku myślano jeszcze, że atomy są najmniejszą możliwą częścią materii. Na przełomie XIX i XX wieku za pomocą szeregu doświadczeń stwierdzono, że atom posiada strukturę wewnętrzną, oznacza to że jest zbudowany z jeszcze mniejszych elementów. W 1913r duński fizyk Niels Bohr zapostulował model budowy atomu, do dzisiaj nazywany modelem budowy atomu Bohra.
Model budowy atomu Bohra przedstawia atom jako dodatnio naładowane jądro oraz ujemnie naładowane elektrony krążące wokół jądra po orbitach kolistych. Od wspomnianych czasów model atomu oczywiście ewoluował, co spowodowane było dalszymi doświadczeniami i związanymi z nimi wynikami. W czasach współczesnych wiadomo, że elektrony są cząstkami elementarnymi (leptonami). Elektron obdarzony jest ładunkiem elektrycznym -1e. Jądro atomu składa się zaś nukleonów. Nukleony to cząstki takie jak proton i neutron. Proton posiada ładunek elektryczny +1e. Neutron jest cząstką obojętną elektrycznie, neutron nie posiada ładunku elektrycznego. Proton i neutron nie są cząstkami elementarnymi. Na podstawie obowiązującej teorii cząstek elementarnych, znaną pod nazwą Model Standardowy, uważa się że proton i neutron zbudowane są cząstek elementarnych nazywanych kwarkami. Kwarki są cząstkami elementarnymi niemożliwymi do zaobserwowania doświadczalnie, ponieważ w przyrodzie nigdy nie występują pojedynczo. Kwarki są specyficznymi cząstkami elementarnymi, ponieważ obdarzone są one ułamkowymi elektrycznymi ładunkami elementarnymi, tj. (1/3)·e, -(1/3)·e, (2/3)·e -(2/3)·e. Kwarki w odpowiedniej konfiguracji powodują, że cząstka wyjściowa składająca się z nich, jest lub nie jest obdarzona elektrycznym ładunkiem elementarnym.
Na podstawie doświadczeń stwierdzono również, że praktycznie cała masa atomu skupiona jest w jego jądrze. Wyjaśnieniem tego faktu, są przybliżone relacje pomiędzy masami elementów składowych atomu:
• me - masa spoczynkowa elektronu
• mp - masa spoczynkowa protonu
• mn - masa spoczynkowa neutronu
me=(1/1834)·mp, mp<mn, mp≈mn
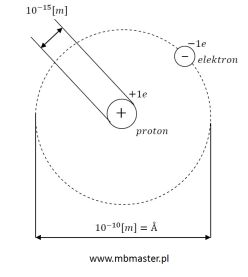
Model atomu na rysunku powyżej, przedstawia atom Wodoru H (łac. Hydrogenium). Wodór jest najprostszym pierwiastkiem chemicznym, jego liczba atomowa Z wynosi 1. Liczba atomowa jest równa liczbie protonów w jądrze atomu. Liczba atomowa pierwiastka chemicznego zapisywana jest jako lewy dolny indeks.
Dla wodoru → 1H
W obrębie jednego pierwiastka chemicznego występować może kilka izotopów. Izotopy danego pierwiastka chemicznego różnią się tylko liczbą neutronów w jądrze. Każdy izotop posiada inną liczbę masową A=N+Z. Liczba masowa reprezentuje sumaryczną liczbę protonów i neutronów w jądrze pierwiastka chemicznego. Liczba masowa zapisywana jest jako prawy górny indeks przy symbolu pierwiastka chemicznego. W przypadku atomu wodoru H, znane są trzy izotopy:
• prot → 1H
• deuter → 2H
• tryt → 3H
W zależności od pierwiastka chemicznego, jego izotopy mogą być stabilne albo niestabilne. Poprzez stwierdzenie izotopy stabilne rozumiemy izotopy niepromieniotwórcze. Poprzez izotopy niestabilne (izotopy promieniotwórcze) rozumiemy izotopy o bardzo krótkim czasie połowicznego rozpadu.